泰格洞见
顶刊CA:2022年美国1800万癌症幸存者数据,显示癌症治疗与生存的新进展
2022年07月14日
兵来将挡,水来土掩。
虽然癌症给摆出一道道难题,但咱也一刻没闲着。无论是突飞猛进还是迂回曲折,随着认知的转变和提升,癌症相关早期检查、治疗技术已是今非昔比。得益于“早发现、早诊断、早治疗”,越来越多的患者在与癌症的斗争中能够死里逃生,成为癌症幸存者。
由美国癌症协会 (ACS) 与美国国家癌症研究所 (NCI) 的研究人员合作调查发现,截止到2022年1月1日为止,美国已有超过1800万癌症幸存者,占总人口的5.4%,预计2040年时人数将增至2600万[1,2]。
在这部分人群中,有2/3为年龄超过65岁的老年人,近半数人在确诊后仍生存达10年之久。他们在治疗中选择的方案包括手术、放疗、化疗、靶向治疗、激素治疗、免疫治疗。经治疗后,影响生活质量的主要因素包括由治疗引起的长期副作用,如疼痛、生育障碍、心理问题;还有不良生活习惯、外界压力等其它因素,如吸烟、经济负担、疫情[1]。
这份《2022年美国癌症患者治疗与生存报告》,于近期发布在著名期刊CA:A Cancer Journal for Clinicians上。

图1:论文首页截图[3]
癌症并非生命的停止键。对于这部分癌症幸存者来说,尚有大把机会演绎美好人生。对于社会来说,如何帮助更多患者脱离癌症的“魔爪”、保障良好生活,是非常值得深入地思索的新问题。
今年年初发布在同期刊CA上的《2022美国癌症数据报告》,展示了癌症发病率、生存率、死亡率等整体趋势[4]。与之相比,这份报告更像一份“幸存者档案”,着眼于癌症患者的治疗方案、生存时长、长期副作用方面的变化趋势。
接下来,咱就给大家分享一些其中重要的内容,看看关于癌症患者的生存情况,有哪些可喜的进展或是暗藏的危机。
小贴士:这份报告采集的是2018年及之前的癌症患者数据,故此无法反应出COVID-19疫情所造成的相关影响。不过,报告中针对新冠疫情的不利影响进行了一系列讨论。
据报告显示,在男性癌症幸存者中,最常见的3种癌症为前列腺癌(n=3523230)、皮肤黑色素瘤(n=760640)、结直肠癌(n=726450)。在女性癌症幸存者中,位列前三的常见癌症为乳腺癌(n=4055770)、子宫体癌(n=891560)、甲状腺癌(n=823800)。
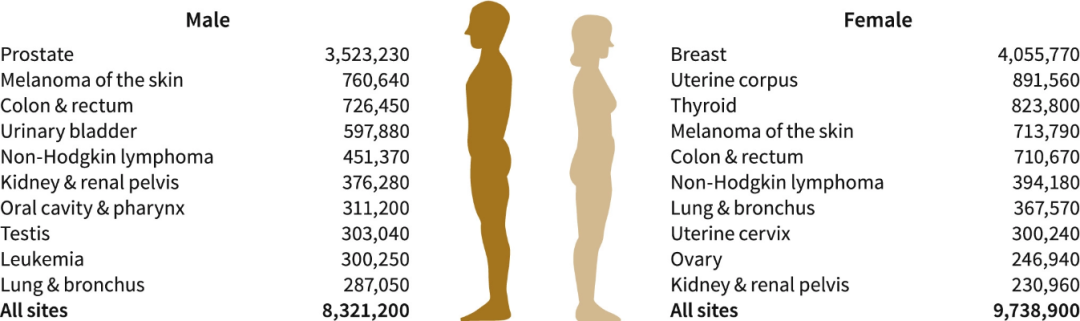
图2:2022年美国男性/女性癌症幸存者患癌统计[1]
由于发病年龄不同,癌症幸存者的当前年龄分布因癌症类型而异。
大体上看,当前年龄≥65岁的老年人居多,占67%。与其它发病部位相比,前列腺癌幸存者普遍年龄偏大,50岁以下的患者占比不到1%,≥65岁的患者则达85%;反观女性的头号威胁——乳腺癌,因发病年龄略早,所以癌症幸存者更为年轻,有6%还没有到50岁。
不同发病部位,生存时间也有差异。
确诊癌症后,有大约69%、47%、18%的患者生存超过5年、10年、20年。肺癌作为癌症中的头号杀手[4],其幸存者面临的挑战也更为险峻,有55%人生存时长不及5年(详见图3右侧图)。
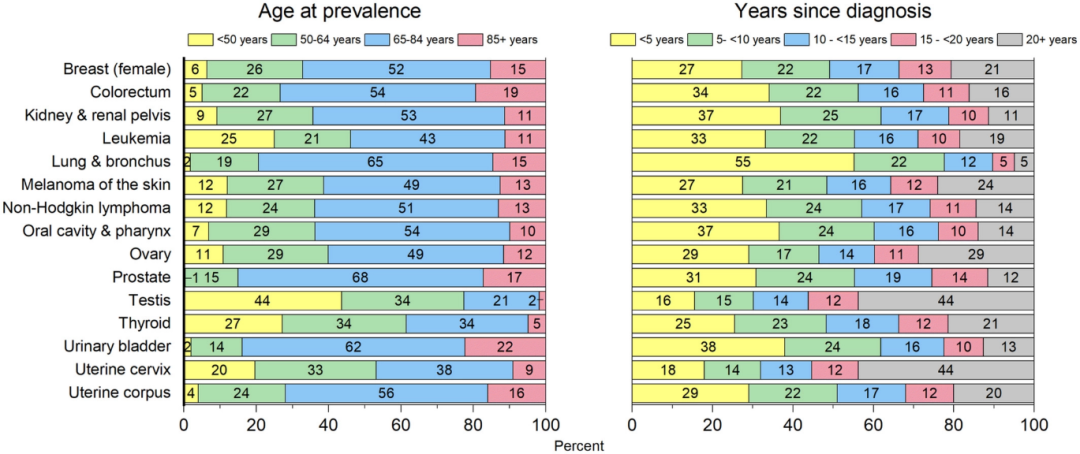
图3:不同发病部位,癌症幸存者的当前年龄、诊断后生存时长[1]
不过从趋势上看,从1970年代至近年来(2011-2017年),几乎所有发病部位的癌症幸存者5年生存率皆有不同程度提升。部分癌症的“成绩”堪称优异,也有几种癌症仍然需要突破瓶颈。
其中,乳腺癌就是受益于“早发现、早诊断、早治疗”的绝佳模范。基于乳腺X射线摄影的普及、激素治疗技术的进步[5],女性乳腺癌患者的5年生存率已从1970年代的75%,提高至近年来的90%。
就连乳腺癌四大亚型当中的“差生”——三阴性乳腺癌,治疗方面也有所进步。三阴性乳腺癌既致命又难攻略,内分泌治疗和HER2靶向药用不上,长期停留在化疗时代。但近几年,免疫联合化疗[6]、抗体-偶联药物(ADC)[7]以及针对BRCA胚系突变靶向抗肿瘤药物[8,9]取得的进展,为早期及转移性乳腺癌患者带来了新的希望。
图4:乳腺X射线摄影
而作为女性癌症的第二大威胁[10]、最常见的妇科癌症之一,子宫体癌患者的生存率则是鲜有提升,与相关治疗进展甚微有关。不过患者生存情况还是比较可观,总体5年生存率为81%,而且超过2/3的子宫体癌患者诊断时为I期,其5年生存率可达95%。
男士们这边也有喜讯。在过去40多年里,前列腺癌患者的5年生存率从68%大跨度提升至98%。这不得不提到一种诊断技术,也就是前列腺特异性抗原检测(PSA),能够实现超早期的前列腺癌诊断,很多还没出现症状的患者也可以被检查出来[11]。
图5:前列腺特异性抗原检测
其他常见发病部位的癌症患者生存情况得到改善,与早期检测、治疗技术的进步也是密不可分。例如甲状腺癌、膀胱癌、皮肤黑色素瘤、睾丸癌,患者5年生存率均有小幅度提升(90%→98%;72%→77%;82%→93%;83%→95%)。
肺癌虽是头号杀手,但人们并没有放任它逍遥法外。随着肺癌分期细化[12]、电视胸腔镜[13]等外科治疗技术的进展,再加上近年来强势突进的靶向药物、免疫药物,非小细胞肺癌(NSCLC)患者的生存情况已得到较大改善;相比之下,小细胞肺癌(SCLC)患者的5年生存率依旧令人堪忧,仅为NSCLC患者的1/4(7% vs 26%)。从整体上看的话,自1990年初以来,肺癌患者的5年生存率几乎翻了一番(13%→22%)。
说起结直肠癌,这几年逐渐成为年轻打工人的热门话题。可能是与饮食结构变化、缺乏运动、肥胖发病率高有关,自2000年以来结直肠癌发病人群迅速年轻化,更加偏好于50岁以下的成年人[14]。好在诊治技术精进不止,自1970年代至近年来,结直肠癌的5年生存率从50%提高至65%。

图6:高脂饮食,隐藏杀手
不止是实体肿瘤,血液恶性肿瘤患者的生存情况也有看点。大多数类型的白血病患者生存率因年龄而异,就拿较为常见的急性髓细胞白血病举例,儿童和青少年患者的5年生存率为69%,而20-49岁、50-64岁、≥65岁的患者5年生存率分别降至58%、35%、9%;个体之间存在巨大差异,对于慢性淋巴细胞白血病患者来说,虽然总体5年生存率为87%,但实际生存时长上至正常预期寿命、下至短短几个月。淋巴瘤患者中,霍奇金淋巴瘤(HL)的5年生存率为88%(经典HL为87%,结节性淋巴细胞为主的HL为96%),弥漫性大B细胞淋巴瘤的5年生存率为64%。
最后,咱们来着重关注一下未来的花骨朵们。从1970年代至近年来,所有儿童和青少年(≤19岁)癌症患者的5年相对生存率显著提高,儿童为58%→85%,青少年为68%→86%。但是报告指出,与儿童患者相比,青少年患者的生存率存在“作弊”情况。由于甲状腺癌、HL青少年患者的生存率较高(>99%、97%),抬高了总生存率;而隐藏在“高分”之下,包括急性淋巴细胞白血病、尤文肉瘤在内的几种癌症,这部分青少年患者的生存率都远低于儿童患者(76% vs 92%;59% vs 76%)。
图7:20岁以下癌症幸存者中,有1/3为白血病患者
当然,即使从癌症手中成功逃脱,治疗的负面效果也不可小觑,极大影响着癌症幸存者的后续生活。
癌症及其治疗最常见的短期、长期副作用包括疼痛、疲劳以及心理问题等[15-17]。具体到不同的发病部位,可能还会有上肢淋巴水肿、膀胱功能障碍、神经系统病变、心肌病、性发育和/或功能障碍、生育能力受损等症状。这些都需要癌症幸存者积极配合长期随访以及相关护理。
除了给癌症幸存者的身心留下后遗症,癌症治疗还会造成不同程度的经济困难。2019年,美国癌症患者与治疗护理相关的总体经济负担超过210亿美元[18]。一旦经济紧张,癌症幸存者则需面对一系列棘手的问题,例如医疗债务、因费用不足而放弃必要的护理、心理压力等。
于是,性价比极高的健康生活方式成为癌症治疗和护理的新起之秀。
大量研究表明,良好的生活方式有助于改善癌症幸存者的器官功能以及生活质量,与降低癌症复发风险相关[19]。为满足更多癌症幸存者的需求,美国癌症协会也是精心制定了健康指南,从饮食方式、体重标准、体育活动等方面列出条条建议[20]。
令人头疼的是,烟瘾难戒。与普通人群的吸烟趋势相似,癌症幸存者的总体吸烟率从1992年的20%下降至2019年的13%。然而,18-44岁的癌症幸存者吸烟率竟然比普通人群的同龄人还高(25% vs 16%)[21]!甚至大约有10%的癌症幸存者,在确诊后长达9年之久仍保持着烟民身份[22]。
话说回来,咱还得紧跟时事。自2019年年底以来,受COVID-19大流行的影响,癌症幸存者步入美好生活的道路又多了一道道关卡,癌症护理的挑战难度升级。
根据一项荟萃分析结果显示,大约1/4的癌症患者因疫情而延误治疗,其中主要因素是由制造或运输问题导致的药物短缺等[23]。其它方面还包括癌症幸存者与护理人员的接触减少、经济压力增加等;平时保持的良好生活习惯也难以再坚持,缺乏运动、吸烟饮酒;在疫情的阴影之下,与普通人群相比,癌症幸存者更容易感到焦虑、抑郁、孤独[24-26]。
值得注意的是,报告中强调,要想评判COVID-19对癌症幸存者的生存影响程度,目前还为时尚早。

图8:面对新冠疫情,没人能逃过它的阴影
总体来说,这份《2022年美国癌症患者治疗与生存报告》指出,人口增长、老龄化+早期检测、治疗技术的进步,使得癌症幸存者群体日益庞大。
同时,癌症治疗及治疗后的护理等方面也暴露出很多问题。据报告分析显示,有色人种地区、低收入地区和农村地区由于可能无法得到适当的早期检测与优质治疗,与其他癌症幸存者的生存情况差距加大。未来应该继续从医疗保健系统、政策、个人意识加强等方面着手,保障癌症幸存者的生活质量。
简单来说就是,对于社会,不要让歧视行为、经济负担、教育问题等成为癌症幸存者迈不过去的坎;对于癌症幸存者呢,咱大风大浪都扛过来了,治疗后积极接受护理、保持健康生活习惯,带“癌”长期生存也并非他人口中虚无缥缈的承诺。
参考文献
[1] Miller, K. D., Nogueira, L., Devasia, T., Mariotto, A. B., Yabroff, K. R., Jemal, A., Kramer, J., & Siegel, R. L. (2022). Cancer treatment and survivorship statistics, 2022. CA: a cancer journal for clinicians, 10.3322/caac.21731. Advance online publication. https://doi.org/10.3322/caac.21731
[2] https://cancercontrol.cancer.gov/ocs/statistics#stats
[3] https://acsjournals.onlinelibrary.wiley.com/doi/full/10.3322/caac.21731
[4] Siegel, R. L., Miller, K. D., Fuchs, H. E., & Jemal, A. (2022). Cancer statistics, 2022. CA: a cancer journal for clinicians, 72(1), 7–33. https://doi.org/10.3322/caac.21708
[5] Berry DA, Cronin KA, Plevritis SK, et al. Effect of screening and adjuvant therapy on mortality from breast cancer. N Engl J Med. 2005;353:1784-1792.
[6] Schmid P, Cortes J, Pusztai L, et al. Pembrolizumab for early triple-negative breast cancer. N Engl J Med. 2020;382:810-821. https://doi.org/10.1056/NEJMoa1910549
[7] Bardia A, Hurvitz SA, Tolaney SM, et al. Sacituzumab govitecan in metastatic triple-negative breast cancer. N Engl J Med. 2021;384:1529-1541. https://doi.org/10.1056/NEJMoa2028485
[8] Robson M, Im SA, Senkus E, et al. Olaparib for metastatic breast cancer in patients with a germline BRCA mutation. N Engl J Med. 2017;377:523-533. https://doi.org/10.1056/NEJMoa1706450
[9] Litton JK, Rugo HS, Ettl J, et al. Talazoparib in patients with advanced breast cancer and a germline BRCA mutation. N Engl J Med. 2018;379:753-763. https://doi.org/10.1056/NEJMoa1802905
[10] Howlader N, Noone AM & Krapcho M et al, eds. SEER Cancer Statistics Review, 1975-2018. National Cancer Institute; 2021. Accessed March 30, 2022. seer.cancer.gov/archive/csr/1975_2018/
[11] Nordström, T., Akre, O., Aly, M., Grönberg, H., & Eklund, M. (2018). Prostate-specific antigen (PSA) density in the diagnostic algorithm of prostate cancer. Prostate cancer and prostatic diseases, 21(1), 57–63. https://doi.org/10.1038/s41391-017-0024-7
[12]Siegel RL, Miller KD, Fuchs HE, Jemal A. Cancer statistics, 2021. CA Cancer J Clin.2021;71:7-33. https://doi.org/10.3322/caac.21654
[13]Jones GS, Baldwin DR. Recent advances in the management of lung cancer. Clin Med (Lond). 2018;18(suppl 2):s41-s46. https://doi.org/10.7861/clinmedicine.18-2-s41
[14] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin.2020;70:7-30. https://doi.org/10.3322/caac.21590
[15] van Leeuwen M, Husson O, Alberti P, et al. Understanding the quality of life (QOL) issues in survivors of cancer: towards the development of an EORTC QOL cancer survivorship questionnaire. Health Qual Life Outcomes. 2018;16:114. https://doi.org/10.1186/s12955-018-0920-0
[16]Wu HS, Harden JK. Symptom burden and quality of life in survivorship: a review of the literature. Cancer Nurs. 2015;38:E29-E54. https://doi.org/10.1097/NCC.0000000000000135
[17]Stanton AL, Rowland JH, Ganz PA. Life after diagnosis and treatment of cancer in adulthood: contributions from psychosocial oncology research. Am Psychol. 2015;70:159-174. https://doi.org/10.1037/a0037875
[18] Yabroff KR, Mariotto A, Tangka F, et al. Annual Report to the Nation on the Status of Cancer, part 2: patient economic burden associated with cancer care. J Natl Cancer Inst. 2021;26:djab192. https://doi.org/10.1093/jnci/djab192
[19] Demark-Wahnefried W, Rogers LQ, Alfano CM, et al. Practical clinical interventions for diet, physical activity, and weight control in cancer survivors. CA Cancer J Clin. 2015;65:167-189. https://doi.org/10.3322/caac.21265
[20] Demark-Wahnefried W, Rogers LQ, Alfano CM, et al. Practical clinical interventions for diet, physical activity, and weight control in cancer survivors. CA Cancer J Clin. 2015;65:167-189. https://doi.org/10.3322/caac.21265
[21] National Cancer Institute. Cancer Trends Progress Report. National Cancer Institute, National Institutes of Health, US Department of Health and Human Services; 2019. Accessed May 7, 2019. progressreport.cancer.gov
[22]Westmaas JL, Alcaraz KI, Berg CJ, Stein KD. Prevalence and correlates of smoking and cessation-related behavior among survivors of ten cancers: findings from a nationwide survey nine years after diagnosis. Cancer Epidemiol Biomarkers Prev. 2014;23:1783-1792. https://doi.org/10.1158/1055-9965.EPI-14-0046
[23] Riera R, Bagattini AM, Pacheco RL, Pachito DV, Roitberg F, Ilbawi A. Delays and disruptions in cancer health care due to COVID-19 pandemic: systematic review. JCO Glob Oncol. 2021;7:311-323. https://doi.org/10.1200/GO.20.00639
[24] Thomson CA, Overholser LS, Hebert JR, Risendal BC, Morrato EH, Wheeler SB. Addressing cancer survivorship care under COVID-19: perspectives from the Cancer Prevention and Control Research Network. Am J Prev Med. 2021;60:732-736. https://doi.org/10.1016/j.amepre.2020.12.007
[25]Jammu AS, Chasen MR, Lofters AK, Bhargava R. Systematic rapid living review of the impact of the COVID-19 pandemic on cancer survivors: update to August 27, 2020. Support Care Cancer. 2021;29:2841-2850. https://doi.org/10.1007/s00520-020-05908-w
[26]Beebe-Dimmer JL, Lusk CM, Ruterbusch JJ, et al. The impact of the COVID-19 pandemic on African American cancer survivors. Cancer. 2022;128:839-848. https://doi.org/10.1002/cncr.33987
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。