泰格洞见
《细胞》:免疫治疗的“关键第一步”!新辅助免疫治疗可以同时诱导肿瘤内和全身T细胞反应!
2022年08月08日
近年来,免疫检查点抑制剂在癌症治疗中的快速发展和重要性有目共睹,对它们的评价通常包括“改变癌症治疗格局”“革命性的癌症治疗进展”,尤其是在转移性癌症中。不过,免疫检查点抑制剂的潜力还不止如此,出于能够调动T细胞积极性的特点,它们还为自己在新辅助治疗中争得了一席之地!
一项Meta分析研究对4项黑色素瘤新辅助免疫治疗临床试验的结果进行了汇总分析,经新辅助治疗后达到完全或主要/部分病理缓解的患者,2年无复发生存率分别高达100%和94-96%[1]。近期,一项在可切除肺癌患者中进行的3期临床试验也发现,新辅助PD-1抑制剂联合化疗相比单纯化疗的无事件生存期更长、完全病理缓解比例更高(24% vs. 2.2%)[2]。
虽然已经在临床中观察到了不错的效果,但是新辅助免疫治疗的机制还没有被研究得很透彻。
最近,在顶级期刊《细胞》上,Dana-Farber癌症研究所的研究人员发表了最新研究结果[3],他们发现,组织驻留记忆(Trm)T细胞是早期响应新辅助免疫治疗的主要T细胞,新辅助免疫治疗可以同时诱导肿瘤内和全身T细胞反应,他们还鉴定出了可以预测治疗响应程度的生物标志物CD38/HLA-DR,以及有潜力作为新免疫治疗靶点的新肿瘤抗原表位。
这些发现有助于在未来更好地为患者选择治疗方案,改善免疫治疗的递送。

论文首页[3]
在这项研究中,研究人员首先分析了他们开展的一项口腔鳞状细胞癌新辅助免疫治疗的2期临床试验[4]的结果。参与试验的29例患者随机分为2组,在手术前接受PD-1抑制剂单药或PD-1/CTLA-4抑制剂联合治疗。
超过一半的患者肿瘤体积显著减小,其中4例患者接近病理完全病理缓解(>90%)/达到病理完全缓解,尽管58.6%的患者在诊断时即存在淋巴结转移,但3年随访结束时,总生存率仍然超过80%,而此前的新辅助化疗研究[5]中患者的3年生存率仅为61.9%(化疗组)和60.2%(无化疗对照组)。这表明,患者接受新辅助免疫治疗能够有显著获益。
接下来,为了搞清楚他们的T细胞反应,研究人员对患者治疗前、治疗期间和手术后的肿瘤活检和/或血液样本进行了单细胞RNA和T细胞受体(TCR)测序。
患者肿瘤样本中的CD8 T细胞可分为两大亚群:表达GZMK和表达GZMB。表达GZMB的细胞还同时表达Trm的标志基因ITGAE(CD103)和ZNF683(HOBIT),这与已知的保护性肿瘤免疫有关[6,7]。ITGAE+T细胞还表达细胞毒性和抑制性受体基因。
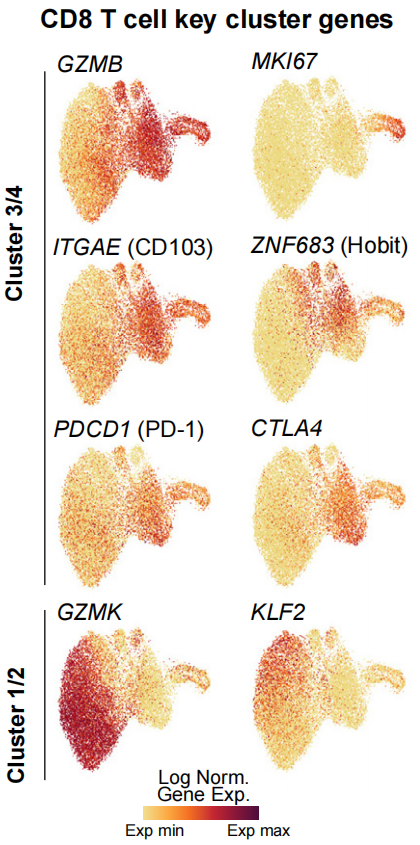
表达GZMK和表达GZMB的两大CD8 T细胞亚群的主要基因表达[3]
所有的CD8 T细胞亚群在治疗前的克隆型(具有相同TCR序列的一组T细胞)规模都差不多,但在治疗后,ITGAE+T细胞克隆型规模更大,这表明,免疫新辅助使得这类T细胞显著扩增。
TCR是肿瘤抗原的第一手接触者,T细胞会在TCR的“提醒”下激活和增殖,以击杀肿瘤细胞。因此,接下来,研究人员进一步确认了响应新辅助免疫治疗扩增的TCR克隆型,他们称之为治疗扩增(Tx-E)TCR。
大多数(59.1%)Tx-E TCR都是治疗前即存在于肿瘤样本中的,剩下的40.9%是被免疫治疗调动起来的,仅在治疗后出现。对比序列可以发现,Tx-E克隆型主要聚集在GZMB/ITGAE+T细胞中,而非Tx-E TCR克隆型则聚集在表达GZMK的T细胞中。这也证实了,对新辅助免疫治疗响应的正是GZMB/ITGAE+T细胞。
肿瘤中Tx-E和非Tx-E T细胞之间的基因表达有着明显的差异,Tx-E T细胞中效应因子、组织驻留、细胞毒性和抑制性受体基因表达增加,包括ITGAE、ZNF683和CXCR6等,这些基因以前在人类上皮细胞分离出的Trm中也被发现过[8,9]。
因为研究人员自己开展的2期临床试验规模太小,他们找来了一项大型的尿路上皮癌免疫治疗试验,以验证Tx-E T细胞的基因特征是否能够用来预测治疗响应和生存率,尿路上皮癌和HNSCC患者的突变负荷和免疫治疗响应率相近,因此可以作为“替代”。结果显示,治疗前的Tx-E T细胞基因组特征果然与治疗响应和总生存率呈正相关关系。
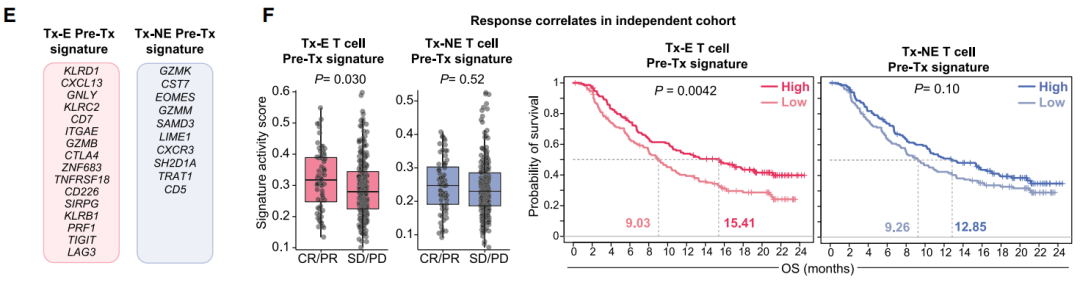
E:Tx-E和非Tx-E T细胞的基因特征;
F:两组基因特征活性评分对完全/部分病理缓解(CR/PR)或疾病稳定/疾病进展(SD/PD)的预测能力(左)和总生存率的预测能力(右)[3]
Tx-E TCR作为特殊的TCR,自然不会是眉毛胡子一把抓,而是有特异性靶向的肿瘤抗原,对患者样本的筛选显示,有6种抗原是Tx-E TCR的靶抗原,其中比较特别的是癌-睾丸抗原MAGEA1的C*07:02限制性表位,这是一种以前未被发现过的新型表位,可能具有成为新免疫治疗靶点的潜力。
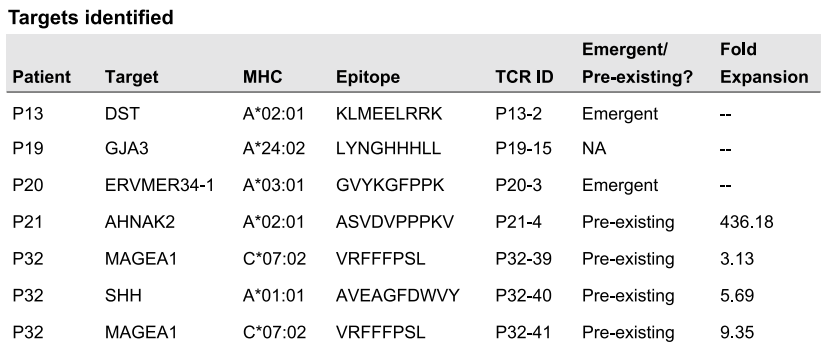
从7例患者中鉴定出的6种靶抗原及其表位等信息[3]
以上这些发现都局限于肿瘤内对治疗的响应,但免疫治疗通常是具有全身响应的,这些TCR特征是否能延伸到全身T细胞响应中呢?研究人员对患者治疗前后的外周血单核细胞进行了单细胞RNA和TCR测序。
他们发现,血液中的CD8 T细胞有一个亚群表现出随时间增加的激活和增殖,这个亚群表达HLA-DRA、CD38和MKI67,而肿瘤中的GZMB/ITGAE+T细胞也高表达CD38和HLA-DR。血液中CD38/HLA-DR+T细胞的TCR序列也与肿瘤中Tx-E TCR相匹配。这种一致性表明了新辅助免疫治疗可以同时诱导局部和全身的免疫反应。
既然肿瘤内和血液中的TCR克隆型具有一致性,那么血液中的T细胞特征或许有潜力成为预测免疫治疗响应的生物标志物。
利用流式细胞术分析患者的血液样本,研究人员发现,治疗前到治疗后2周,激活的CD38/HLA-DR+ T细胞亚群逐渐扩增,它们在治疗前的水平与病理缓解程度呈正相关。另外,治疗前和治疗中的PD-1+KLRG1-(KLRG1是一种终末分化标志物)T细胞水平也与病理缓解程度呈正相关,而单独的PD-1+ T细胞水平则不具有这种相关性。
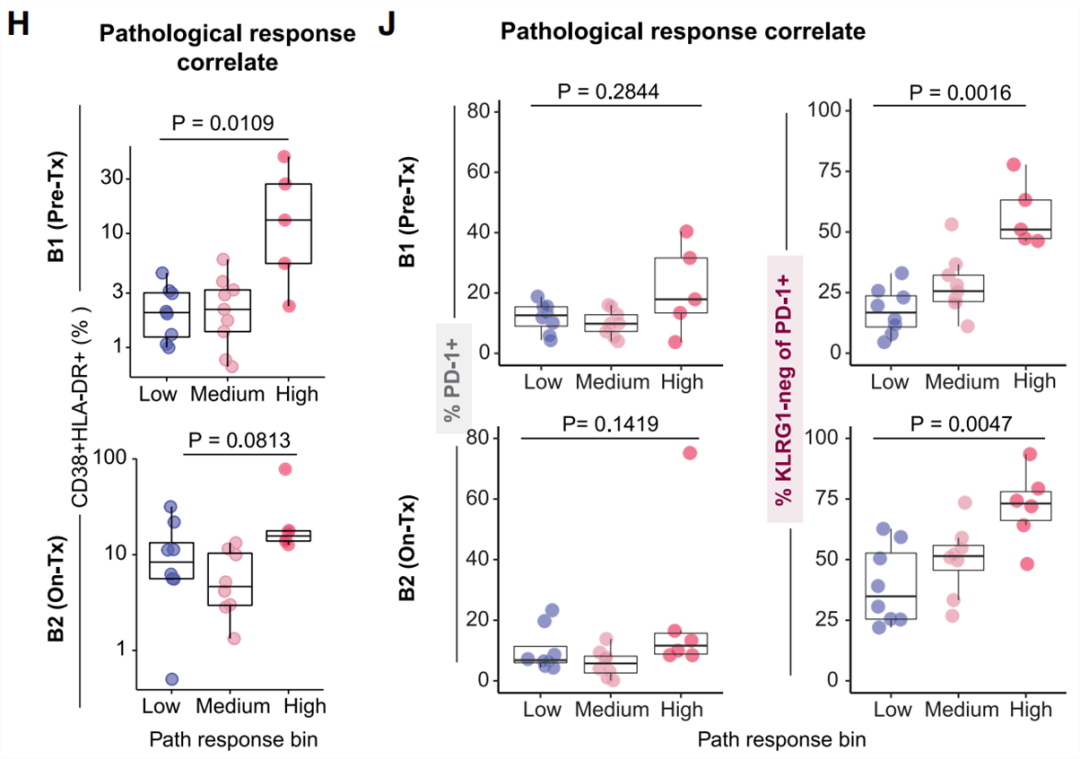
H:治疗前(B1)和治疗中(B2)CD38/HLA-DR+ T细胞亚群与病理缓解程度的关系
J:治疗前(B1)和治疗中(B2)PD-1+ T细胞和PD-1+KLRG1- T细胞与病理缓解程度的关系[3]
总的来说,这项研究确定了Trm T细胞是早期响应新辅助免疫治疗的T细胞之一,并且鉴定出了可以预测治疗响应程度的T细胞生物标志物和有潜力作为新免疫治疗靶点的新肿瘤抗原表位。另外,研究还证明,新辅助免疫治疗在早期即可诱导全身性免疫反应,这对预防肿瘤转移非常重要。
研究人员指出,他们的发现有一个比较特殊的地方在于,PD-1+T细胞的比例与治疗响应无关,有关的是终末分化标志物KLRG1阴性的PD-1+T细胞。他们目前的研究重心锁定在了Trm T细胞对肿瘤免疫治疗的重要性方面,这不仅与免疫检查点抑制剂的未来应用有关,还可能影响CAR-T等其他免疫疗法[10]。
参考资料
[1] Menzies A M, Amaria R N, Rozeman E A, et al. Pathological response and survival with neoadjuvant therapy in melanoma: a pooled analysis from the International Neoadjuvant Melanoma Consortium (INMC)[J]. Nature medicine, 2021, 27(2): 301-309.
[2] Forde P M, Spicer J, Lu S, et al. Neoadjuvant nivolumab plus chemotherapy in resectable lung cancer[J]. New England Journal of Medicine, 2022.
[3] Luoma A M, Suo S, Wang Y, et al. Tissue-resident memory and circulating T cells are early responders to pre-surgical cancer immunotherapy[J]. Cell, 2022.
[4] Schoenfeld J D, Hanna G J, Jo V Y, et al. Neoadjuvant nivolumab or nivolumab plus ipilimumab in untreated oral cavity squamous cell carcinoma: a phase 2 open-label randomized clinical trial[J]. JAMA oncology, 2020, 6(10): 1563-1570.
[5] Licitra L, Grandi C, Guzzo M, et al. Primary chemotherapy in resectable oral cavity squamous cell cancer: a randomized controlled trial[J]. Journal of Clinical Oncology, 2003, 21(2): 327-333.
[6] Park S L, Gebhardt T, Mackay L K. Tissue-resident memory T cells in cancer immunosurveillance[J]. Trends in immunology, 2019, 40(8): 735-747.
[7] Savas P, Virassamy B, Ye C, et al. Single-cell profiling of breast cancer T cells reveals a tissue-resident memory subset associated with improved prognosis[J]. Nature medicine, 2018, 24(7): 986-993.
[8] Kumar B V, Ma W, Miron M, et al. Human tissue-resident memory T cells are defined by core transcriptional and functional signatures in lymphoid and mucosal sites[J]. Cell reports, 2017, 20(12): 2921-2934.
[9] Szabo P A, Levitin H M, Miron M, et al. Single-cell transcriptomics of human T cells reveals tissue and activation signatures in health and disease[J]. Nature communications, 2019, 10(1): 1-16.
[10] https://acir.org/weekly-digests/2022/july/resident-memory-t-cells-are-ready-to-respond-in-neoadjuvant-checkpoint-blockade
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。