泰格洞见
New to Real——美国FDA真实世界研究拨款资助方向变化的分析与启示
2023年04月21日
根据《21世纪治愈法案》,美国FDA近年来不断探索真实世界数据(RWD)和真实世界证据(RWE)的潜在用途,以支持新药适应症的批准或批准药物的批准后研究要求。2020年开始,美国FDA宣布进行拨款设立奖项计划,以探索和支持使用RWD在监管决策中生成RWE,确保支持上市批准的科学证据符合FDA的高证据标准。
一、概述:美国 FDA 真实世界研究拨款资助方向的主要变化
2023年,FDA出台了新的拨款奖项说明,下面就让我们对比一下2020和2023的说明,看看在哪些地方都发生了变化吧。[1][2]
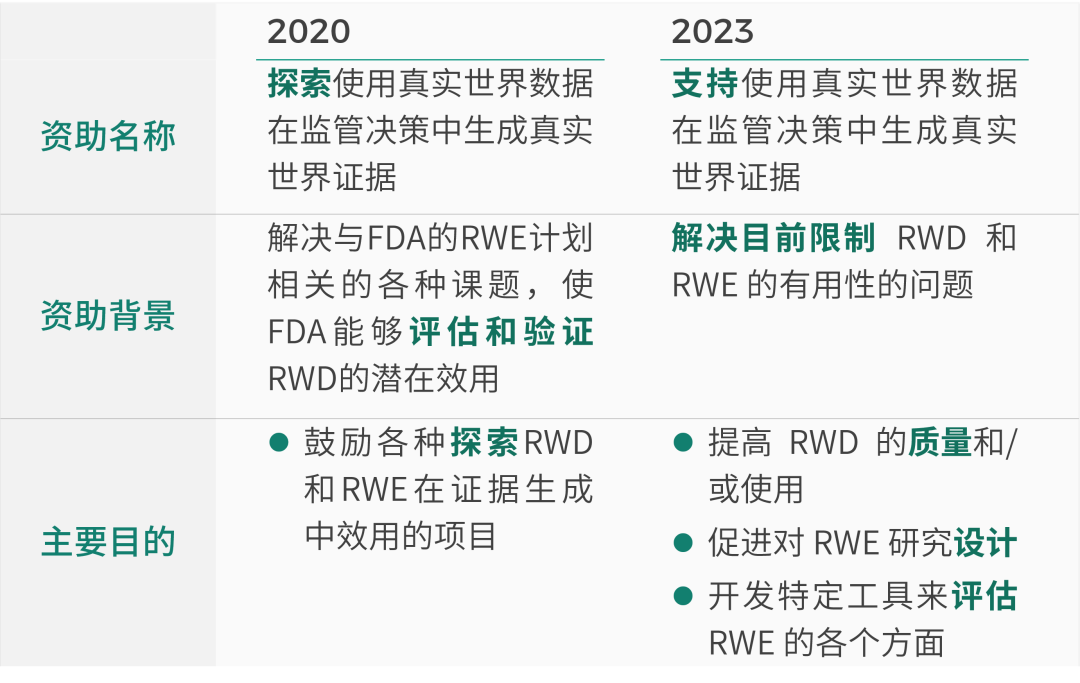
从这三年的资助方向变化我们可以看到,真实世界研究作为一种新的科学研究方法,其重要性日益增强,正越来越多地用于支持药物研发和监管决策中。业界大力支持积极探索真实世界研究用于药品研发,尤其是经过严密的策划、设计、收集、分析等环节、最终形成高质量的用于支持监管决策的真实世界证据。
二、分析:结合案例看美国 FDA 真实世界研究拨款资助方向的具体条目变化[3]
1. RWS 监管地位变化

2020获奖案例:应用新的统计方法为混合随机对照试验设计开发决策框架,该框架将内部对照组与来自真实世界数据源的患者数据相结合
该项目探索和制定设计研究的建议,这些研究可以可靠和严格地结合来自不同来源的数据(例如,RCT和RWD),并生成可用于支持监管决策的证据。这类设计的价值在于可以通过减少样本量和/或缩短样本量来提高临床试验的效率。同时,为了评估这些研究设计,研究团队将使用模拟研究、已完成临床试验的数据和 RWD 来源,并开发并公开提供可用于评估特定混合研究的R包。
我们可以看到,正是由于这一领域RWS的成功,2023年FDA的资助方向扩展到各种项目类型,包括药物和生物制品。相信未来,通过RWS的助力,会进一步缩短创新药物的上市时间,帮助患者更快地获得药物。会出现更多的支持安全、快速、有效开发创新药物的“RWS通道“,助力化学实体药物、生物药品、新适用症以及改良型药品快速上市。
2. RWS 人群范围变化

2020获奖案例:推进标准和方法,通过新生儿试点项目从真实世界数据中生成真实世界证据
尽管存在许多基于新生儿重症监护病房临床护理的综合数据集,但缺乏系统整合、数据共享和数据标准,极大地限制了新生儿药物的开发。该项目将支持从全球许多主要利益相关者那里收集新生儿重症监护室(NICU)数据。然后,数据将被存入真实世界的数据和分析平台(RW-DAP)。数据将用于定义新生儿常用实验室值的可操作参考范围、创建支气管肺发育不良(早产新生儿中常见的慢性肺病)的自然史模型等,收集的电子病历数据将有助于设计和进行新生儿临床试验。
我们可以看到,相比之前的未描述,2023年资助项目的人群明确了要增强临床患者的多样性研究,包括历史上代表性不足的人群。对于RCT未覆盖的“特殊人群“,都是属于有特定生命阶段的一个群体,可能需要特殊的护理与照料,可能具有与RCT人群不同的生理、病理和药理等特征,因此在筛查诊断、药物干预等各方面,均需要额外的研究来扩充传统知识库与诊疗循证依据。
3. RWS 数据挑战变化

2020获奖案例:使用非结构化和结构化数据转换真实世界证据,以推进定制治疗
随着RWE越来越多地用于临床断言,需要严格的方法学方法来维持证据标准。这个项目旨在了解基础数据质量对RWE研究结果的影响。在真实世界临床研究中对同一患者群体进行了比较传统的RWE方法(使用声明或健康记录结构化数据)与更先进的RWE方法(包括深度表型和数据链接)。使用这两种方法时获得不同的结果表明,可能需要具有高数据有效性的先进技术才能获得可靠的RWE结果。在监管和临床领域实施真实世界证据(RWE) 途径是迈向个性化医疗、改善护理和更高效护理的一步。数据质量的基础研究促进了RWE的应用。
我们可以看到,2023年资助项目对于RWS数据的相关要求,由之前的处理、标准化,更多的变为治理和转换。数据质量是决定研究质量的底线,未来会更多地综合常见的数据标准、人工智能领域的自然语言处理技术、提升数据质量的创新型数据采集模式,根据最简化的数据模型制定文本数据标签指南,优化数据转化过程。
4. RWS 资源价值变化
2020获奖案例:通过将随机临床试验 (RCT) 与真实世界数据 (RWD) 联系起来来加强证据生成
该项目研究使RCT与RWD相关联的好处,如将RCT与RWD联系起来,通过将患者的随访时间延长到试验完成之后,捕获额外的有效性和安全性结果,采用方法最大限度地减少缺失数据以及将RCT结果推广到现实世界的目标人群来增强试验。通过实施RCT与RWD相关联的RCT,也将提高对RCT和非随机研究之间潜在差异的根本原因的理解。项目发现,RWS与RWD联系是一种低成本、高收益的策略,应更多在未来的RCT中采用。
我们可以看到,2023年资助方向中,RWD源不再孤立,而是更多和RCT等注册研究资源链接。RWS与RCT的互补关系,将进一步体现在药品的生命周期计划中,共同作为整体进行科学合理的研究设计和统计规划。
三、启示
1. 未来 RWS 应更多助力监管决策、加快药物开发
这几年,中国真实世界证据也逐渐运用于肿瘤领域药物的注册上市,为单臂临床试验的解读提供研究背景。尤其是对于少数群体(如罕见病)等临床试验中代表性较低的人群,RCT实施起来常常遇到样本量稀少而无法选用对照组等困难,真实世界证据有助于获取这类人群的临床信息及证据。未来,真实世界证据在这方面的价值,也值得我们进一步关注。
2. 未来 RWS 应提供更多“特殊人群“证据
中国近年也与国外一样,建立了中国新生儿协作网(Chinese Neonatal Network,CHNN)[4]等登记组织,用于开展基于真实世界数据的系列临床研究。这些组织发展迅速,以CHNN为例,现已纳入全国25个省(自治区、直辖市)、98家医院、积累了超过30000例极/超低出生体重儿注册登记的多中心数据资料,未来这些RWE数据,将对包括新生儿罕见病诊疗、罕见病新药早期准入、新生儿全生命周期管理等方面发挥越来越重要的作用。未来,作为更贴近真实诊疗环境的RWS,将纳入很多RCT研究无法纳入的人群(比如孕妇、老年人、一般情况较差的患者),为药物治疗,提供了更多的应用场景,为临床诊疗提供更加坚实的证据。
3. 未来 RWS 应构建标准化数据体系以保证数据质量
2021年,药审中心组织制定了《用于产生真实世界证据的真实世界数据指导原则(试行)》,从真实世界数据的定义、来源、评价、治理、标准、安全合规、质量保障、适用性等方面,对真实世界数据给出了具体要求和指导性建议,并于4月13日发布并施行。近年来。我国在系统化地构建各细分领域的登记数据库基础上,制定了一系列更加详细的登记指南(如《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[5]),来确保从源头上提升数据质量。然而,由于我国辗转求医路径的特殊性导致了多源异构复杂的RWD,未来,还必须构建标准化的RWD体系,才能保证高质量的研究数据产出,RWS研究也需更多根据自身特点,选择合适的数据体系模式,采用标准化的RWD体系构建流程,完成高质量、规范化的临床研究[6]。
4. 未来 RWS 将不再孤立,与 RCT 成为有机整体
在我国,药物研发阶段,已经有一些RWS产生的RWE作为RCT的协同证据,如在药物同质化较严重的治疗领域,合理的对照药选择是RCT设计的关键,可以通过多臂RWS来确定最合适的对照药物;又如在双盲状态下开展的RCT,可以通过RWS作为外部对照或历史对照,实现提前预知和判断RCT的研究结论,帮助新药有机会更快地获得监管机构批准。但药物获批上市仅仅是探索药物临床价值的起点,不仅《药品注册管理办法》从监管角度,规定了附条件批准上市的药物,或药品批准文号有效期5年届满需再生产的药物,需要补充更多的上市后研究证据,越来越多的申办方自己也意识到,药物上市后各类医学证据的完善、补充和升级中RWS有广阔的用武之地。RWS可以回答在RCT里未被解决的科学问题,如扩大样本量后的疗效和安全评估、新的用法用量、新的联合用药方案、完善和修订说明书等。RWS被广泛用于定位产品优势、挖掘新的干预方法、升级循证依据、实现市场拓展,以及基于用药特征的患者画像分析等。未来,随着医学界、工业界和监管机构对RWS的认知越来越深入, RCT和RWS之间将更多的相互结合、相互补充、相互成就。
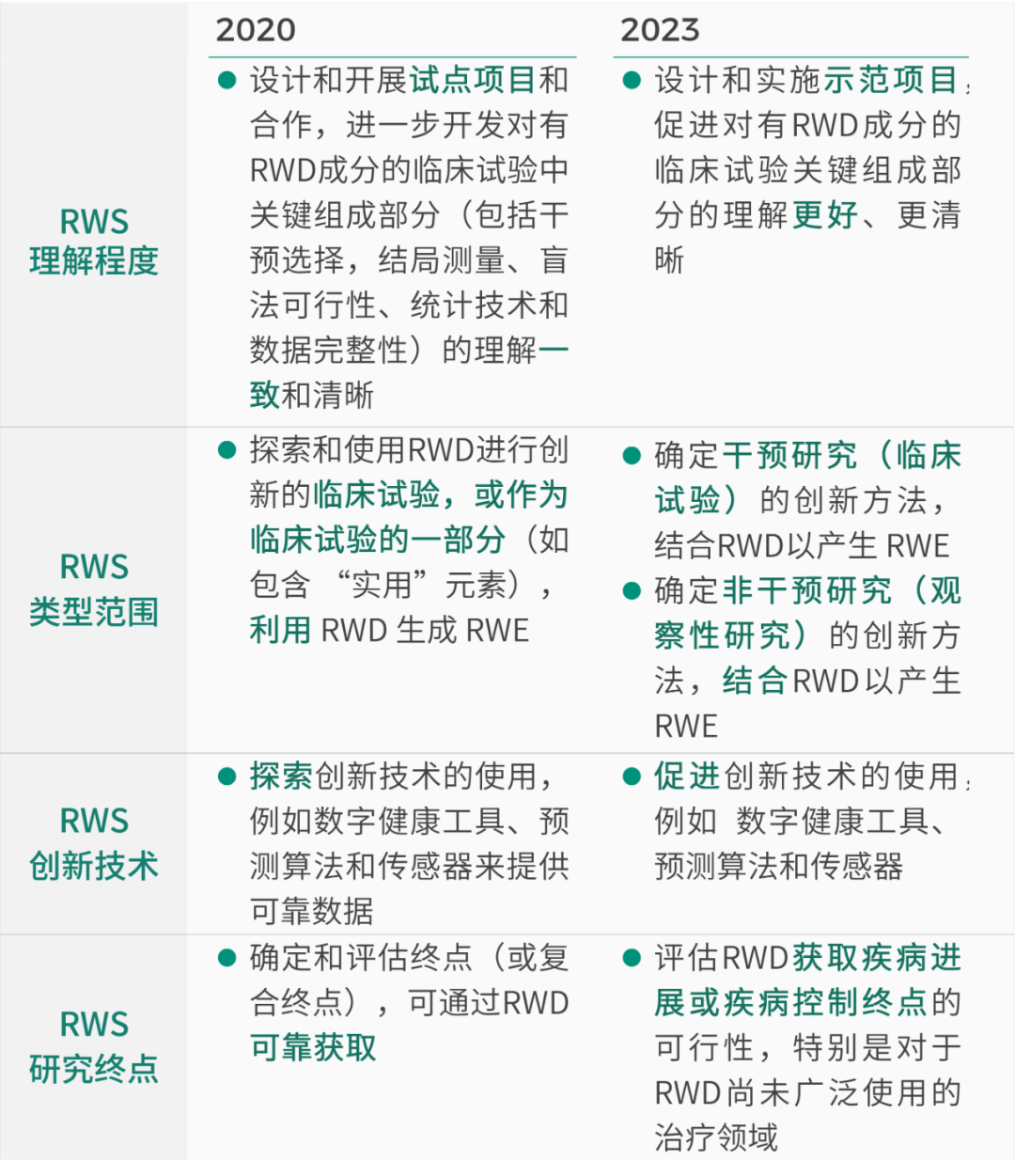
附:美国 FDA 真实世界研究拨款资助方向的其他条目变化一览
撰写 | 周旋
审核 | 孙丽霞、王震宇
泰格医药真实世界研究部
参考资料:
Exploring the use of Real-World Data to Generate Real-World Evidence in Regulatory Decision-Making (U01) Clinical Trials Optional https://grants.nih.gov/grants/guide/rfa-files/RFA-FD-20-030.html
Supporting the use of Real-World Data to Generate Real-World Evidence in Regulatory Decision-Making (U01) Clinical Trials Optional https://grants.nih.gov/grants/guide/rfa-files/RFA-FD-23-025.html
FDA Announces 4 Grant Awards for Projects Exploring the Use of Real-World Data to Generate Real-World Evidence in Regulatory Decision-Making https://www.fda.gov/drugs/science-and-research-drugs/fda-announces-4-grant-awards-projects-exploring-use-real-world-data-generate-real-world-evidence
曹云,LEE SHOO K,周文浩. 基于真实世界的新生儿临床研究:推动最佳医疗实践和质量改进[J]. 中华围产医学杂志,2022,25(8):565-569.
中国胃肠肿瘤外科联盟,中国抗癌协会胃癌专业委员会. 中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)[J]. 中国实用外科杂志,2018,38(6):589-595.
刘艳梅,任燕,贾玉龙,等. 真实世界数据体系构建的模式探索[J]. 中华流行病学杂志,2022,43(3):418-423.
本网站使用Cookies以使您获得最佳的体验。为了继续浏览本网站,您需同意我们对Cookies的使用。想要了解更多有关于Cookies的信息,或不希望当您使用网站时出现Cookies, 请阅读我们的Cookies声明。